维迪西妥单抗
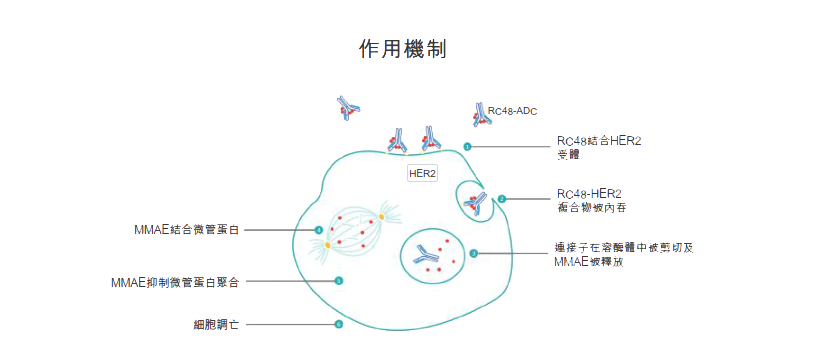
作用机制
ADC为一种将化疗药物直接靶向运输至肿瘤细胞并保留健康细胞的高度靶向性癌症疗法。ADC的概念基于利用单克隆抗体对选定的肿瘤细胞表面抗原的高特异性,并通过附着高效细胞毒素剂以增强抗体的细胞杀伤力。通常而言,将每个抗体分子上连接多个高效细胞毒性化合物分子,以增强其活性,同时保留抗体的良好药代动力学及药效学性质。该种疗法的关键是使三种不同的分子(抗体、活性药物及连接子)协同作用。
与不加区分地损害健康细胞及肿瘤细胞的传统化疗不同,ADC利用单克隆抗体结合肿瘤特异性抗原靶点,然后输送化疗药物(一种高效的细胞毒素剂)以杀死肿瘤细胞。在此方法下,ADC产生较少的不良事件或严重不良事件,从而使癌症患者显著受益。
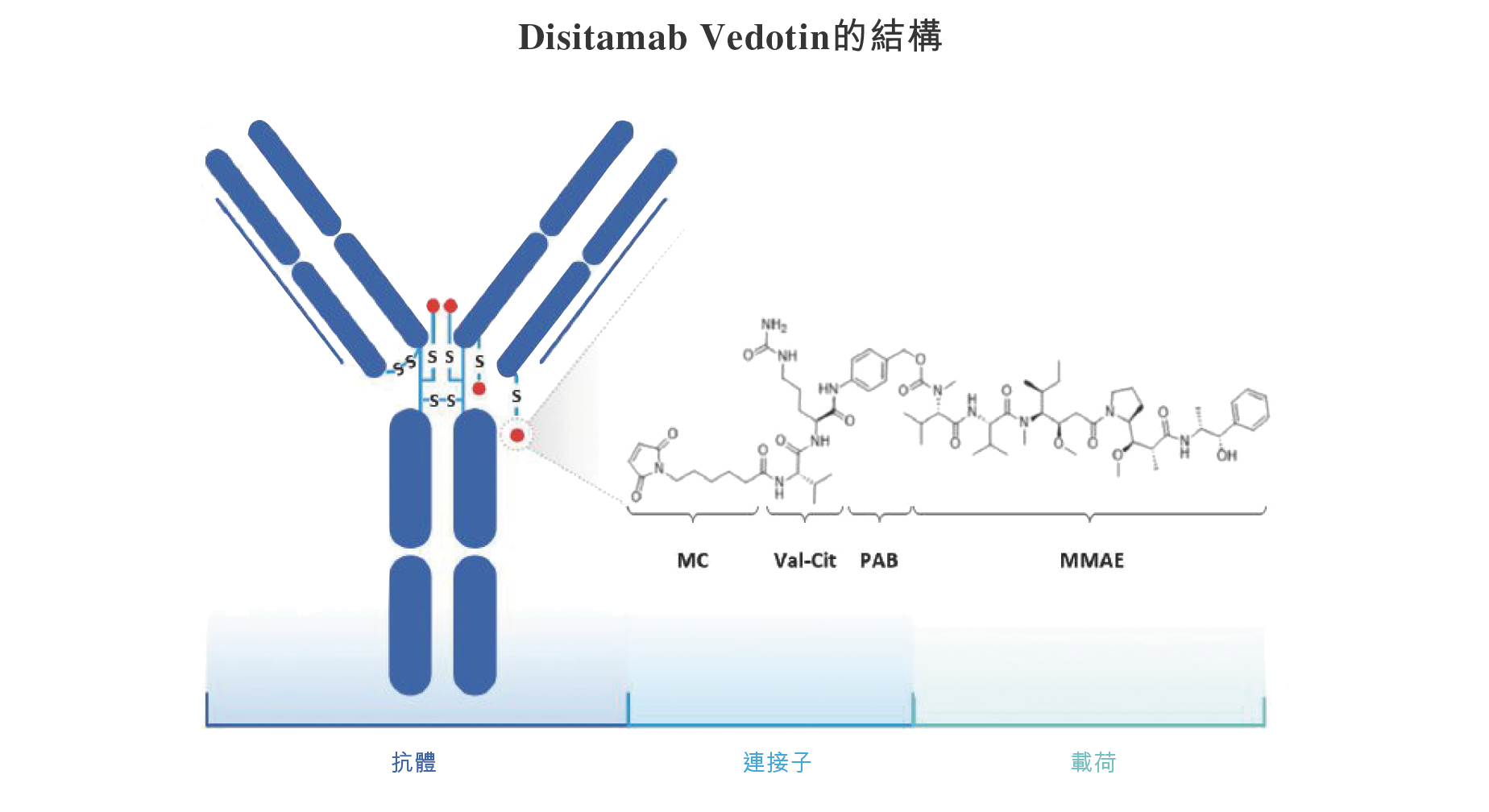
缩写:MC = maleimidocaproyl;MMAE = 一甲基澳瑞他汀E;PAB = p-aminobenzyl。
附注:MC-Val-Cit-PAB为蛋白酶可剪切的ADC连接子。
如上图所示,维迪西妥单抗里有一种新型人源化HER2抗体和一甲基澳瑞他汀E(MMAE)[一种半最大抑制浓度(IC50)在亚纳摩尔等级范围内的有效微管蛋白结合剂,作为毒素载荷],他们通过可被组织蛋白酶可剪切的连接子彼此偶联,并具有优化的药物-抗体比率。抗HER2抗体可使维迪西妥单抗将抗癌剂MMAE选择性地输送至HER2表达肿瘤细胞。
HER2为表皮生长因子受体(EGFR)家族的成员,在许多组织中表达,包括乳房、胃肠道、肾脏和心脏。在该等组织中的主要作用是促进细胞增殖和抑制细胞凋亡。HER2基因的扩增及其产物的过表达可能促进过度或不受控制的细胞生长及肿瘤生成。我们的临床数据支持HER2途径可能在许多表达HER2抗原的肿瘤类型的癌症(如乳腺癌、胃癌、肺癌及泌尿道上皮细胞癌)的治疗中起关键作用这一科学观点。
维迪西妥单抗包含靶向肿瘤细胞上HER2受体不同表位并显示出高结合亲和力的新型HER2单克隆抗体。一旦维迪西妥单抗通过其抗体成分(disitamab)结合在肿瘤细胞表面表达的靶点(HER2),ADC-HER2复合物就会通过内吞作用被肿瘤细胞内吞。然后连接抗体和细胞毒性载荷的连接子在溶酶体蛋白酶存在下被剪切。一旦载荷MMAE被释放到细胞质中,它就会与微管蛋白结合并抑制其聚合,从而触发细胞凋亡或HER2表达肿瘤细胞程序性死亡。MMAE一旦被释放,也具有杀死邻近肿瘤细胞(无论是否为HER2表达)的能力,这被称为旁杀效应。研究发现,与具有较低膜通透性载荷的ADC相比,具有较高膜通透性载荷的ADC(如MMAE)具有更强的旁杀效应,表明我们的维迪西妥单抗具有更高的抗肿瘤潜力。
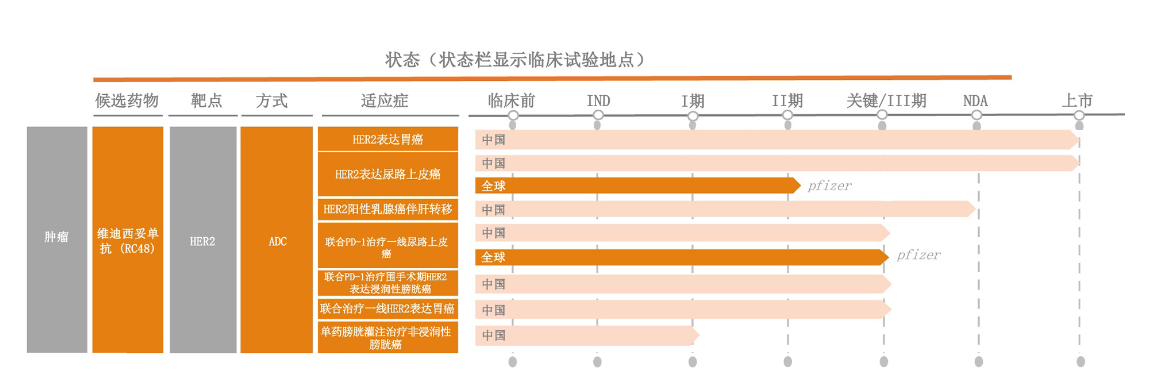
适应症
维迪西妥单抗是我国首款获批上市的国产ADC(抗体-偶联)新药,也是我国首个获得美国FDA、中国国家药监局突破性疗法双重认定的ADC药物。维迪西妥单抗胃癌、尿路上皮癌适应症分别于2021年6月、2021年12月获中国药监局批准上市销售,并分别于2022年1月、2023年1月进入国家医保药品目录。2024年10月,单药治疗二线HER2阳性乳腺癌伴肝转移适应症的上市申请获CDE受理,并被纳入优先审评审批程序。
竞争优势
• 结构设计优势
采用自主研发、经筛选优化后的单克隆抗体,具备更高的靶点亲和力。
采用优化后可酶切的连接子,基于“旁杀效应”提高对肿瘤组织的整体杀灭效果,同时提高 ADC 药物的血液稳定性和安全性。
• 生产优势
ADC药物的研发和生产涉及抗体大分子药物、高效化学药物、偶联方法等一系列关键技术,技术难度大、工艺要求高。我们通过自主研发,目前已突破了维迪西妥 单抗从抗体制备、连接子和细胞毒素结合、偶联工艺及制剂优化、药理研究、质量评价到规模化生产等环节的技术瓶颈,积累了ADC药物从研发源头直到商业化生产的全部关键技术。我们目前的ADC药物生产能力完全满足临床试验用药及当前产业化的需求,形成了较高的技术壁垒。
• 临床前及临床疗效优势
基于优化后的靶点亲和力及对肿瘤组织的“旁杀效应”,维迪西妥单抗可选择性抑制HER2阳性肿瘤细胞增殖、诱导细胞周期阻滞及细胞凋亡,并已经在临床前及临床试验中展示了良好的疗效及安全性。